O experimento que será explicado neste artigo pode ser realizado em sala de aula a fim de determinar o volume molar de um gás. O professor pode aplicar essa atividade exatamente após o estudo teórico do volume molar dos gases. Esse conteúdo baseia-se na hipótese de Avogadro, que diz que volumes iguais de quaisquer gases que estão nas mesmas condições de temperatura e pressão apresentam o mesmo número de moléculas.
Assim, quando consideramos as Condições Normais de Temperatura e Pressão (CNTP), em que a pressão é igual a 1 atm e a temperatura é de 273 K (0ºC), temos que o volume ocupado por 1 mol de qualquer gás sempre será de 22,4 L. Esse valor corresponde ao volume molar dos gases.
Se considerarmos as Condições Ambientais de Temperatura e Pressão (CATP), em que a pressão também é de aproximadamente 1 atm, mas a temperatura é de 298 K (25 ºC), o volume molar passará a ser 25 L.
Por meio desta proposta de aula, o professor pode mostrar como realizar a determinação do volume de um gás em litros, relacioná-lo com o volume molar dos gases nas CNTP e nas CATP, bem como relembrar com os alunos outros conceitos fundamentais de Química que foram vistos em estudos anteriores.
Esta atividade experimental envolve, por exemplo, a ocorrência de reações e a sua representação por meio de equações químicas; cálculos estequiométricos envolvendo grandezas tais como volume, massa, massa molar e número de mol (quantidade de matéria); e a aplicação da equação de estado dos gases.
Veja agora como você pode realizar esta atividade experimental sobre volume molar dos gases.
Materiais e reagentes:
-
Balança;
-
Termômetro;
-
Proveta de 200 mL;
-
Água
-
Vinagre;
-
Bicarbonato de sódio;
-
Mangueira fina transparente;
-
Recipiente (tipo uma bacia) de vidro;
-
Garrafa PET de 500 mL;
-
Rolha;
-
Algo para fazer um furo na rolha a fim de fazer a mangueira passar por ela.
Procedimento experimental:
1- Conforme já mencionado na parte dos “materiais e reagentes”, faça um furo na rolha do tamanho que dê para passar a mangueira, mas não deixe espaço, pois o objetivo é que o gás não escape por nenhum espaço, somente pelo interior da mangueira;
2- Pese cerca de 0,5 g do bicarbonato de sódio e anote o valor exato da massa usada;
3- Faça a medição da temperatura do vinagre com o termômetro e anote;
4- Encha a proveta de água e encurve-a sobre o recipiente de vidro, que também deve estar com água;
5- Coloque a outra extremidade da mangueira dentro da proveta;
6- Este passo deve ser realizado rapidamente para não haver nenhuma perda de gás: coloque cerca de 50 mL de vinagre na garrafa PET, adicione o bicarbonato pesado e feche a garrafa com a rolha e a mangueira acoplada. O sistema ficará parecido com o mostrado na figura a seguir:
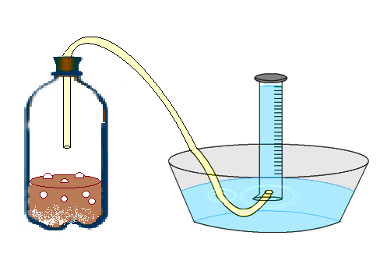
Experimento sobre volume molar de um gás
Resultados e discussão:
Professor, você pode pedir para que os alunos relatem o que aconteceu e quais mudanças eles observaram tanto na solução dentro da garrafa quanto no volume da água dentro da proveta. Eles devem dizer qual foi a reação que ocorreu dentro da garrafa, representar sua equação e dizer qual foi o gás obtido.
Depois, peça que, com os dados obtidos, eles usem uma das equações aprendidas no estudo dos gases para determinar o volume do gás coletado.
Não pare agora... Tem mais depois da publicidade ;)
No início desse experimento foi adicionada água na proveta, mas ela não foi simplesmente emborcada sobre a água do recipiente, pois era necessário retirar o ar atmosférico que havia dentro dela. Assim, o gás que ficou dentro da proveta no final do experimento era totalmente puro.
A reação foi realizada entre o bicarbonato de sódio, que é o sal hidrogenocarbonato de sódio ou carbonato ácido de sódio, cuja fórmula é NaHCO3, e o vinagre, que é uma solução aquosa de ácido acético (H3CCOOH). Essa reação pode ser representada pela seguinte equação:
NaHCO3(s) + H3CCOOH(aq) → H3CCOONa(aq) + H2CO3(aq)
Visto que o ácido carbônico (H2CO3(aq)) é instável, ele decompõe-se:
NaHCO3(s) + H3CCOOH(aq) → H3CCOONa(aq) + H2O(l)+ CO2(g)
Assim, o gás obtido nessa reação foi o gás carbônico ou dióxido de carbono (CO2), e a sua produção pode ser vista por meio da formação de bolhas.
A equação que pode ser usada para determinar o volume molar do dióxido de carbono nesse experimento é a equação de estado dos gases ou PV = nRT. Veja como os alunos podem determinar cada uma das grandezas dessa fórmula:
P = pressão local em atm;
V = é o volume em litros ocupado pelo gás CO2 e é o que desejamos obter para comparar com o volume molar dos gases. Por isso, a equação ficará assim:
V = nRT
P
T = temperatura do vinagre que foi medida no início. Mas não se esqueça de passar de graus Celsius (ºC) para a escala kelvin (k). Para tal, basta somar o valor da temperatura em ºC com 273,15;
R = é a constante universal dos gases, cujo valor é igual a 0,082 atm . L / k . mol;
n = é a quantidade de matéria de CO2. Para encontrar o seu valor, usamos os seguintes cálculos:
84 g/mol de NaHCO3 (essa é a massa molar) ----------- 1 mol
m (massa pesada que foi usada no experimento) ---------- nbicarbonato
Aqui teremos a quantidade de matéria (n) do bicarbonato de sódio usado como reagente. Agora fazemos outra regra de três para calcular a massa de CO2 obtida:
1 mol de NaHCO3 ---------- 44 g de CO2
n mol de NaHCO3 (que foi obtido no cálculo anterior) ---- mCO2
Com essa massa (mCO2) e a massa molar do CO2 (44 g/mol), descobrimos a quantidade de matéria de CO2 que foi produzida pela seguinte proporção:
44 g de CO2 ----------- 1 mol
mCO2 ---------- nCO2
O valor de nCO2 é então substituído na equação dos gases ideais. Dessa forma, encontra-se o volume, em litros, do gás CO2.
É importante que o professor ajude os alunos a verem a relação do valor encontrado por eles nesse experimento com o volume molar nas CNTP, que, conforme dito no início deste artigo, é de 22,4 L. Pela relação V = nRT/P, se o valor da temperatura medida pelos alunos for menor que a temperatura nas CNTP, o volume encontrado também será menor e vice-versa. A pressão também influencia de modo inversamente proporcional, ou seja, se a pressão local for menor que 1 atm (que é a pressão estabelecida nas CNTP), então o valor do volume do gás será maior que 22,4 L.
Por Jennifer Fogaça
Graduada em Química








