O modelo de Bohr, como o próprio nome já diz, foi criado pelo físico Niels Bohr para explicar algumas incoerências presentes no modelo de Rutherford, como o fato de um elétron orbitar o núcleo e não perder energia. Este texto traz uma proposta de trabalho para que o professor(a) possa explicar o modelo de Bohr de forma prática. Vamos à proposta!
Introdução
Inicialmente o professor(a) deve explicar o modelo de Bohr de forma simples, mas abrangendo cada um dos postulados que esse cientista propôs:
-
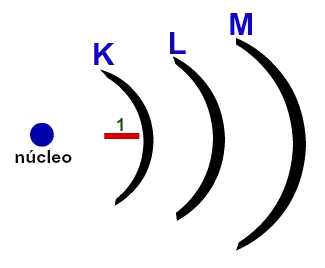
Um átomo apresenta até sete níveis de energia (K, L, M, N, O, P, Q);
-
Cada nível apresenta uma quantidade determinada de energia;
-
Os elétrons de cada nível apresentam uma quantidade de energia compatível com a energia do nível em que ele está;
-
A energia contida em um elétron é fixa;
-
Elétrons podem ser excitados ao receberem uma quantidade de energia vinda de uma fonte externa ao átomo;
-
Um elétron excitado sempre se desloca (salto quântico) para outro nível por estar com uma quantidade maior de energia;
-
Um elétron que sofreu salto quântico sempre libera a energia que recebeu na forma de luz;
-
Ao liberar a energia, o elétron retorna para o seu nível de origem.
Veja uma sugestão de desenho que pode ser utilizada para explicar o modelo:
Materiais e reagentes necessários
-
Bico de bunsen (de preferência). Caso não tenha um disponível, pode ser utilizada a chama de um fogão, por exemplo;
-
Óculos de proteção;
-
Jalecos;
-
Béqueres;
-
Baqueta;
-
Espátula;
-
Balança;
-
Água destilada;
-
Um fio de níquel cromo (pode ser adquirido em lojas de reagentes e materiais para laboratórios, assim como todos os sais a seguir);
-
Cloreto de sódio (NaCl);
-
Nitrato de lítio (LiNO3);
-
Cloreto de potássio (Kcl);
-
Nitrato de bário [Ba(NO3)2];
Não pare agora... Tem mais depois da publicidade ;)
-
Sulfato de cobre II (CuSO4);
-
Cloreto de cálcio (CaCl2 );
-
Cloreto de estrôncio (SrCl2 ).
Procedimento
Para evitar acidentes, sugerimos que o professor(a) seja o responsável por manusear o bico de bunsen.
1o) De acordo com o número de alunos presentes em sala, o professor(a) deve dividir a turma de forma que cada grupo trabalhe com um sal;
2o) Com o béquer, o grupo deve preparar uma solução que apresente 3 gramas (pesadas na balança) de sal em 50 mL de água destilada;
3o) O grupo deve fazer um arco na ponta do fio de níquel cromo;
4o) Em seguida, o grupo deve molhar o arco na solução preparada e levar até a chama do bico de bunsen;
5o) Observar se ocorre alguma modificação na chama do bico de bunsen com a presença do fio de níquel cromo.
Discussão

Os fogos de artifício exemplificam o modelo de Bohr
Com os resultados de cada grupo, o professor pode discutir com os alunos a relação entre esses resultados e o modelo de Bohr. Sugerimos uma reflexão sobre os seguintes tópicos:
-
Houve mudança na coloração da chama do bico de bunsen?
-
Se houve mudança na coloração da chama, o que ocasionou essa alteração?
-
Como é possível relacionar esse experimento com o modelo de Bohr?
-
Qual outro evento do dia a dia pode ser relacionado com o modelo de Bohr?
-
Houve repetição da coloração da chama do bico de bunsen entre os grupos?
-
Se não houve repetição da coloração, por que isso ocorreu?
Cada um desses tópicos está, de certa forma, embasado na introdução teórica que sugerimos. É fundamental que os alunos entendam o comportamento dos elétrons mediante o recebimento de energia.
Por Me. Diogo Lopes Dias