PUBLICIDADE
Esse experimento bastante divertido pode ser realizado pelo professor e pelos alunos dentro da sala de aula mesmo. O professor pode utilizar essa estratégia de ensino para ensinar os conteúdos de “Forças intermoleculares”, principalmente as “Ligações de hidrogênio” e também o conteúdo de “carboidratos ou glicídios”, que trata dasoses oumonossacarídeos.
Mais adiante será explicada a relação desses conteúdos com o experimento proposto. Por enquanto, porém, vejamos o segredo para se obter bolhas de sabão grandes e que demoram a estourar.
Procedimento:
Misture em um recipiente 100 mL de detergente para lavar louça, 100 mL de água e 50 mL de xarope de milho.
Se quiser, você pode fazer uma quantidade maior dessa “receita”, apenas tome o cuidado para seguir a proporção de 1: 1: ½. Isto é, se, por exemplo, você colocar 500 mL de água, terá que adicionar 500 mL de detergente e 250 mL de xarope de milho.
Deixe a mistura descansar por dois dias para que ela fique homogênea sozinha, pois não é uma boa ideia agitá-la, e depois é só se divertir, usando um aro com suporte feito de arame grosso. Lembre-se que o aro deve ser menor que a boca do recipiente.
Relação do experimento com conteúdos de Química:
As ligações de hidrogênio são as forças intermoleculares mais intensas que existem e elas são atrações que ocorrem entre átomos de hidrogênio ligados a átomos de flúor, oxigênio e nitrogênio.
Na água, esse tipo de interação ocorre entre os hidrogênios das moléculas de água, que representam o polo positivo; e os oxigênios, que representam o polo negativo. Essa interação ocorre em todas as direções – somente no caso das moléculas da superfície da água que isso não ocorre, pois não há moléculas em todas as suas direções e isso cria a chamada tensão superficial da água. Assim, é isso que ocorre com as moléculas que estão na superfície da bolha: elas realizam ligações de hidrogênio apenas com as moléculas que estão ao seu lado. A fim de diminuir essa superfície ao mínimo e ficar mais estável, a bolha adquire o formato esférico, com menor área de superfície e volume.
O detergente é um agente tensoativo ousurfactante, pois ele diminui essa tensão superficial da água. A bolha se mantém sem estourar em virtude das interações entre as moléculas de água que restaram depois de se adicionar o detergente.
É aí que entra o papel principal nesse experimento do xarope de milho. Ele é formado por 80% de glicose e 20% de frutose, que são monossacarídeos ouoses. Essas substâncias possuem em sua estrutura vários grupos hidroxila (OH), conforme mostra a figura a seguir:
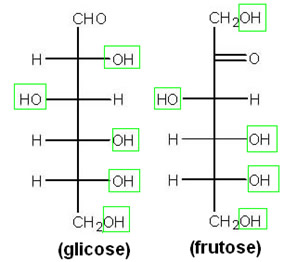
Essas várias hidroxilas aumentam a quantidade de ligações de hidrogênio, pois haverá esse tipo de ligação entre suas moléculas e também com as moléculas de água. Como resultado, a evaporação da água na superfície da bolha será dificultada e as bolhas demorarão mais tempo para estourar; além de se tornarem mais resistentes, aumentando a probabilidade de se fazer bolhas maiores.
Essa função do xarope de milho nos mostra que é possível usar no lugar dele qualquer substância que apresente vários grupos OH em sua estrutura, como a sacarose, por exemplo, que é o açúcar comum, e a glicerina.
Por Jennifer Fogaça
Graduada em Química







