Eletrólise do Iodeto de Potássio
Esse experimento de eletrólise em meio aquoso do iodeto de potássio consiste em misturá-lo com uma solução de amido e fenolftaleína.
Esse experimento pode ser utilizado em sala de aula para demonstrar na prática e reforçar para os alunos os conceitos estudados sobre Eletrólise em Meio Aquoso.
Materiais e reagentes:
- Retroprojetor;
- Transparência (folha de acetato usada em retroprojetores);
- 1 g de iodeto de potássio (KI(s));
- Solução diluída de amido;
- Fenolftaleína;
- 1 placa de Petri ou alguma tigela de vidro;
- Colher de plástico ou vareta de vidro para misturar as soluções;
- Conta-gotas;
- 2 cilindros de grafita com tamanho de 3 cm (você pode obter retirando do interior de um lápis de escrever ou comprando pontas de grafite mais grossas em papelarias);
- 1 bateria de 9 volts;
- 2 conectores elétricos (garra-jacaré).
Procedimento experimental:
1. Misture na placa de Petri um pouco da solução de amido (até aproximadamente metade da placa) com o iodeto de sódio;
2. Adicione uma gota de fenolftaleína;
3. Coloque a transparência sobre o retroprojetor, e por cima dela a placa de Petri com a mistura;
4. Prenda a extremidade de cada uma das garras-jacaré em uma grafite e ligue o sistema à bateria, tomando o cuidado para somente as grafites estarem na solução, mas as garras-jacaré não; conforme a figura ilustra:

5. Observe o que ocorre e anote os resultados.
Obs.: essa experiência também pode ser feita com água no lugar da solução de amido, mas o efeito não será tão bonito.
Resultados e discussão:
O professor poderá realizar perguntas aos alunos para ver se eles conseguiram identificar os seguintes pontos mais importantes:
- Substância que se forma noânodo: visto que o iodeto (I1-(aq)) é um ânion menos reativo que o hidróxido (OH-(aq)), o iodeto vai se descarregar no ânodo primeiro, conforme a semirreação anódica a seguir:
2 I1-(aq) → I2(s) + 2e-
Observe que há a formação de iodo. Posteriormente, esse iodo reage com os íons iodeto da solução, formando o íon complexo tri-iodeto I31-(aq):
I2(s) + I1-(aq) → I31-(aq)
Esses íons complexos se inserem no interior da amilose na forma de novelo, o que acarreta na formação de um complexo de cor azul intensa:
I31-(aq) + amido → complexo azul de I31-e amido
Se for usada a água no lugar da solução de amido, o resultado será uma cor castanha, em razão da baixa presença de iodo na água.
- Substância que se forma nocátodo: nesse caso, o íon hidrônio (H3O1+(aq)) é um cátion menos reativo que o potássio hidrônio (K1+(aq)). Portanto, o hidrônio irá se descarregar primeiro do cátodo, sendo que a sua semirreação é dada por:
2 H3O1+(aq) + 2e- → 2 H2O(l) +1 H2(g)
O retroprojetor mostra mais claramente as bolhas formadas no cátodo pelo hidrogênio que é liberado.
- Com o tempo, a solução adquire uma coloração vermelha, isso ocorre porque, conforme mostrado no item anterior, os íons hidrônio estão sendo consumidos, então a solução passa a se tornar um meio básico e a fenolftaleína é um indicador ácido-base, que em meio básico fica vermelha.
- Equação global do processo:
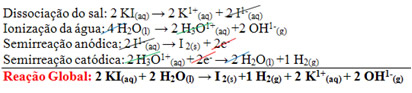
Por Jennifer Fogaça
Graduada em Química
Fonte: Brasil Escola - https://educador.brasilescola.uol.com.br/estrategias-ensino/eletrolise-iodeto-potassio.htm