
Introdução:
A eletrólise é uma reação de oxirredução não espontânea que é iniciada pela passagem de corrente elétrica em um meio em que os íons estejam livres. Isso pode ser conseguido por meio da fusão de substâncias iônicas (eletrólise ígnea) ou sendo feita em meio aquoso (eletrólise aquosa).
Entre outras aplicações, a eletrólise é muito usada para revestir peças com metais que se oxidam mais facilmente que o metal constituinte da peça, protegendo-o contra a corrosão. O nome desse processo é eletrodeposição e pode se dar de duas maneiras principais: por eletrólise de purificação e também por galvanoplastia.
A galvanoplastia reveste a peça, colocando-a como o cátodo em um circuito de eletrólise. Já a eletrólise de purificação é um tratamento metalúrgico do minério. O mais utilizado na indústria é a purificação do cobre, que pode ser vista com mais detalhes no texto “Eletrólise com Eletrodos Ativos” .
Esse efeito é conseguido resumidamente porque o cobre metalúrgico de uma placa funciona como o ânodo, liberando cátions que migram e se depositam sobre o outro polo, à medida que a corrente elétrica passa.
Nesse experimento iremos fazer uma cobreação, em que revestiremos uma chave de cobre. Esse experimento também pode ser feito com outros materiais feitos de metal, como moedas.
Objetivo:
Mostrar uma das possíveis aplicações da eletrólise, identificando as reações envolvidas.
Materiais e reagentes:
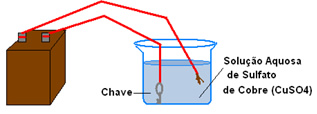
- Bateria conectada a dois fios de cobre (o fio também pode ser conectado a uma placa de cobre, como mostrado nos objetos da imagem abaixo);
- Solução aquosa de sulfato de cobre (CuSO4);
- Frasco transparente (pode ser um copo ou um béquer);
- Uma chave.

Procedimento experimental:
1. Coloque no frasco transparente a solução de sulfato de cobre;
2. Prenda a chave a um dos fios que saem da bateria;
3. Mergulhe-a na solução;
4. Coloque a ponta do outro fio na solução. Se você tiver um fio conectado na placa, mergulhe essa placa na solução;
5. Anote o que é observado tanto na cor da chave, como na cor da solução.
Resultados e Discussão:
A partir do que foi realizado e das explicações dadas em sala de aula sobre o conteúdo de eletrólise, o professor pode explorar dos alunos aspectos como: quem foi o cátodo, quem foi o ânodo, qual era o papel da solução aquosa de sulfato de cobre, quais foram as semirreações envolvidas, qual é a reação global, entre outros pontos relacionados.
Por Jennifer Fogaça
Graduada em Química
