Quando o professor começa a abordar o conteúdo de isomeria óptica, um tipo de esteroisomeria, o aluno sente uma maior dificuldade para identificar os enantiômeros. Isso ocorre porque na isomeria plana ou constitucional (que geralmente é vista antes da isomeria espacial ou esteroisomeria) a diferença entre os isômeros pode ser vista facilmente nas cadeias carbônicas, por meio de diferentes grupos funcionais, ou pelo tipo de cadeia carbônica, ou, ainda, pelo posicionamento da insaturação ou da ramificação.
Na isomeria óptica, porém, a diferença entre os enantiômeros (isômeros que são a imagem especular um do outro e que não são sobreponíveis) é vista somente pela configuração da molécula, ou seja, pela disposição espacial dos átomos. Poucas pessoas possuem de imediato o dom de visualizar no espaço a diferença entre dois enantiômeros.
É por isso que se utilizam modelos como o mostrado a seguir, que possibilitam que o professor e os alunos construam as estruturas das moléculas e visualizem a sua disposição espacial.

No entanto, nem todos os alunos, principalmente de Ensino Médio, têm condições de comprar um kit desses de química orgânica. Assim, o objetivo desse texto é mostrar como o professor pode construir junto com os alunos um modelo com materiais mais baratos e de fácil obtenção e usá-los para iniciar uma discussão que envolva as ideias necessárias para o estudo da esteroisomeria relativa à assimetria do composto.
Sugere-se que o professor realize essa atividade experimental em grupos de três alunos, sendo que cada grupo deve ter os materiais necessários, que estão listados a seguir, para a realização da proposta:
Materiais:
- Farinha de trigo;
- Sal;
- Água;
- Óleo;
- Corante alimentício em 4 cores diferente;
- Tigela ou bacia de plástico;
- Palitos de dente;
- Espelho pequeno;
- Medidores (como xícara e colher de sopa).
Procedimento:
- Misture duas xícaras da farinha de trigo com uma xícara de sal;
- Misture bem com as mãos e vá acrescentando água aos poucos, até que a mistura adquira uma consistência de massa de pão;
- Separe a massa em cinco partes e acrescente um corante diferente em cada uma, de forma que fiquem homogeneizadas. (Obs.: Não é necessário colocar em uma parte da massa, pois o objetivo é conseguir cinco cores diferentes. Além disso, para economizar mais, você pode usar só dois corantes, como o amarelo e o verde, que misturados dão outra cor, o azul. As outras duas partes podem ser conseguidas com tonalidades diferentes, uma mais intensa e outra mais clara);
- O professor pode propor que os alunos façam a estrutura de um tetraedro, no qual o carbono central é quiral ou assimétrico, ou seja, possui quatro ligantes diferentes. Pode pedir que peguem a massa com cor mais intensa e façam uma bolinha para ser o carbono central. Depois deve fazer bolinhas com cores diferentes, que serão os ligantes, usando os palitos de dentes para espetar as bolinhas umas nas outras (serão as ligações).
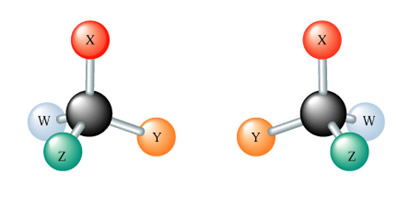
Primeiro os alunos fazem dois tetraedros exatamente iguais. Posteriormente, devem tentar construir duas moléculas quirais, como as mostradas abaixo, em que se muda a posição dos ligantes.
Não pare agora... Tem mais depois da publicidade ;)
Uso do modelo construído:
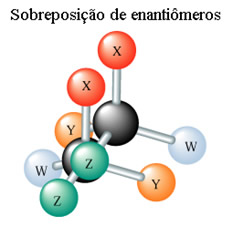
Professor, peça aos alunos que tentem posicionar as moléculas que são iguais uma sobre a outra e ver se as bolinhas de cores iguais ficam exatamente na mesma posição. Nesse caso, os alunos verão que as moléculas são sobreponíveis, ou seja, é possível posicionar uma sobre a outra, de modo que as posições dos ligantes de mesma cor irão coincidir. Com isso, os alunos devem concluir que as duas são a mesma molécula e não enantiômeros.
Depois faça o mesmo procedimento, mas com os modelos diferentes e peça aos alunos para dizerem o que observam. Agora, eles verão que a posição das cores dos átomos ligantes não ficará no mesmo lugar, portanto eles não são sobreponíveis, não sendo a mesma molécula, mas sim enantiômeros.
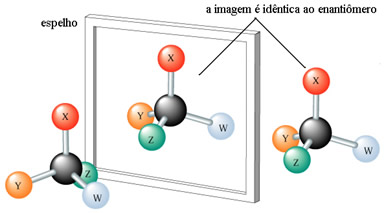
O professor também pode pedir que os alunos coloquem o primeiro modelo construído em frente ao espelho; e o outro modelo, que é igual ao primeiro, ao lado do espelho, de modo que ele fique na mesma posição da imagem refletida. Ao fazerem isso, os alunos verão que o modelo colocado ao lado é diferente da imagem. Por serem moléculas idênticas, elas não são a imagem especular uma da outra.
Depois eles devem repetir o mesmo processo, porém, colocando o modelo diferente ao lado do espelho. Nesse momento, os alunos poderão concluir que por serem modelos com os mesmos tipos de átomo, mas com diferentes arranjos espaciais, suas moléculas serão a imagem especular uma da outra. Logo, podemos posicionar uma molécula de modo idêntico ao da imagem da outra no espelho.
Por Jennifer Fogaça
Graduada em Química