Introdução:
O Princípio de Le Chatelier diz que quando é causada algum tipo de perturbação num sistema em equilírbio, este se deslocará no sentido que tende a anular essa perturnação, procurando retornar ao estado de equilíbrio.
Por exemplo, se aumentarmos a concentração dos reagentes de uma reação reversível, o equilíbrio se deslocará no sentido direto, isto é, da formação dos produtos e de consumo dos reagentes. O contrário também é verdadeiro, se aumentarmos a concentração dos produtos, o equilíbrio químico será deslocado no sentido iverso, de consumo dos produtos e formação dos reagentes.
Mas, além da concentração existem outros fatores que podem alterar o equilíbrio iônico de uma reação química. Dois deles são o número de coordenação do cátion metálico (quantidade de ânions que cercam o cátion no arranjo cristalino) e o grau de hidratação (quantidade de moléculas de água que existem no arranjo cristalino do sal).
Isso acontece, por exemplo, no caso de alguns sais, tais como o cloreto de cobalto e o sulfato de cobre. O cloreto de cobalto II (CoCl4) é muito usado nos conhecidos “galinhos do tempo”, que são bibelôs que mudam de cor, ajudando a prever se irá chover ou se fará calor.
Quando o cloreto de cobalto II está em solução aquosa, estabelece-se o seguinte equilíbrio químico:
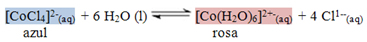
O íon [CoCl4]2-(aq) apresenta cor azul, sendo que o número de coordenação de seu cátion é 4 e ele é anidro, isto é, não possui moléculas de água em seu arranjo cristalino. Já o íon [Co(H2O)6]2+ apresenta cor rosa, sendo que seu número de coordenação é igual a 6 e ele é hidratado.
Essa solução é passada nos bibelôs citados. Assim, quando o tempo está seco, o sal fica da cor azul e indica que provavelmente não irá chover. Além disso, a temperatura alta do ambiente desloca o equilíbrio no sentido da reação endotérmica, que absorve calor, que é a inversa:
.jpg)
Não pare agora... Tem mais depois da publicidade ;)
No entanto, em dias bastante úmidos o galo fica da cor rosa, devido à presença de água de cristalização, indicando possibilidade de chuva. A temperatura baixa favorece o deslocamento do equilíbrio para o sentido direto (de formação do sal rosa), pois essa é uma reação exotérmica, com liberação de calor:
.jpg)
Esse mesmo princípio vale para o sulfato de cobre (CuSO4) que quando está anidro é branco, mas quando está hidratado fica da cor azul:

Isso pode ser mostrado por meio do experimento a seguir:
Materiais e Reagentes:
- Sulfato de cobre hidratado II (CuSO4 . n H2O);
- Lamparina;
- Pregador de madeira;
- Tubo de ensaio.
Procedimento Experimental:
1.Coloque uma pequena quantidade do sulfato de cobre II no tubo de ensaio;
2.Segurando com o pregador, aqueça o tubo de ensaio na lamparina acesa;
3.Observe o que acontece com a cor do sal;
4.Deixe o sistema em repouso durante certo tempo;
5.Observe novamente o que acontece com a cor do sulfato de cobre.
Resultados e Discussão:
O sal inicialmente é hidratado, por isso, apresenta coloração azul. Mas quando ele é aquecido, sua água evapora e ele se torna branco. Com o tempo e em repouso ele absorve a umidade do ar e começa a se tornar azul novamente.

A variação da temperatura também é outro fator que alterou o equilíbrio; pois quando ela foi aumentada, a reação se deslocou no sentido da reação que absorve calor, endotérmica, e quando a temperatura foi diminuindo, o equilíbrio de deslocou no sentido da reação que libera calor, exotérmica.
O professor pode pedir para que os alunos expliquem o ocorrido, escrevam as equações químicas envolvidas, indiquem qual é exotérmica e qual é endotérmica e se esse fenômeno obedece ao Princípio de Le Chatelier.
Por Jennifer Fogaça
Graduada em Química







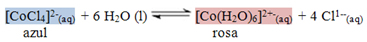
.jpg)
.jpg)

