PUBLICIDADE

Introdução:
Existem três estados de agregação ou estados físicos para a água, que são: sólido, líquido e gasoso. A passagem de um estado para outro se dá por aquecimento ou resfriamento do sistema.
No momento em que se passa de um estado físico para outro, a temperatura se mantém constante até que toda a substância termine de mudar de estado. Por exemplo, ao aquecermos o gelo, ao nível do mar, sua temperatura irá aumentar gradativamente, até que ao atingir 0°C (Ponto de Fusão (PF)) ele começará a passar para o estado líquido. Porém, a temperatura do gelo não continua aumentando. Mesmo continuando a aquecer o sistema, o material analisado só terá sua temperatura superior a 0°C depois que todo gelo passe para o estado líquido.
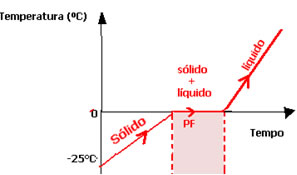
O mesmo acontece em 100°C (Ponto de Ebulição (PE)), temperatura na qual ocorre a passagem do líquido para o sólido, ao nível do mar. A água permanecerá nessa temperatura até que todo o líquido passe para o estado de vapor.
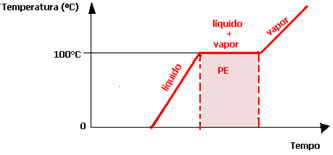
Transpondo esses dados para um gráfico, obtemos o seguinte diagrama de mudança de estado físico da água abaixo:
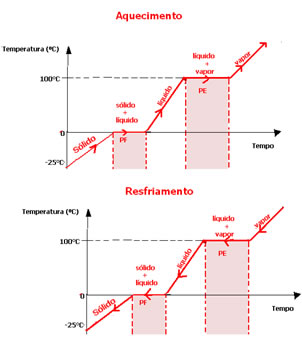
Entretanto, em altitudes diferentes, as temperaturas de fusão e de ebulição serão também diferentes de 0° C e 100°C, respectivamente. Isso pode ser mostrado na prática, para que os alunos entendam melhor esse conteúdo e possam construir eles próprios um diagrama de mudança de estado físico da água, analisando se a pressão na região em que vivem é maior ou menor que ao nível do mar.
Outro ponto importante, é que, normalmente, somente substâncias puras apresentam PF e PE fixos. Substâncias impuras, como misturas, não terão esses pontos de temperatura constante. Além disso, o ponto de fusão de uma mistura será sempre menor do que o da substância pura. Já o ponto de ebulição será sempre maior na mistura.
Materiais e reagentes:
- Água;
- Sal de cozinha;
- Béquer;
- Termômetro;
- Tripé. Tela de amianto, lamparina ou Bico de Bunsen;
- Bastão de vidro;
- Suporte universal.
Procedimento:
Monte com os materiais citados anteriormente uma aparelhagem segundo o esquema a seguir:
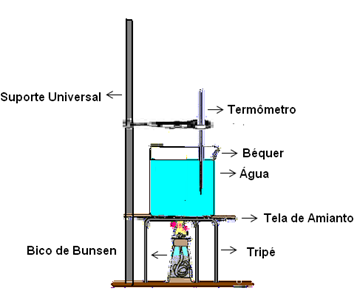
Primeiramente meça a temperatura inicial (ambiente) da água pura. Em seguida ligue o bico de Bunsen e anote as temperaturas em seu caderno em intervalos de 1 minuto. Não se esqueça de misturar levemente.
Anote a temperatura em que a água entrou em ebulição e, depois de 5 minutos, anote novamente a temperatura do líquido.
Repita o processo, porém com uma mistura de água e sal.
Construa o gráfico de mudança de estado físico para os dois casos e discuta os resultados.
Por Jennifer Fogaça
Graduada em Química





