
Comecemos apresentando a constante de ionização que mede a força de um ácido:
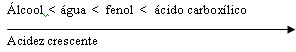
Como se vê, à medida que a seta caminha para direita, mais forte fica o ácido. Esta classificação é baseada na quantidade de íons H+ liberados pelo ácido em meio a uma reação. Quanto mais H+ mais forte será o ácido.
A constante apresentada acima explica por que somente alguns ácidos orgânicos reagem com bases inorgânicas: ácido carboxílico (acidez maior) reage mais facilmente com bases inorgânicas do que fenol.
Observação: Dizemos que um ácido é orgânico quando este se faz presente em nosso organismo ou nos alimentos que ingerimos. O ácido acético (CH3COOH) é um exemplo de ácido carboxílico presente em frutas.
Prove a força ácida realizando o experimento abaixo. Você vai precisar de:
• Bicarbonato de sódio (NaHCO3)
• Ácido carboxílico
• Fenol
• 2 pires
Procedimento:
1. Coloque cerca de 100 gramas de Bicarbonato de sódio em cada pires;
2. Acrescente ácido carboxílico em um dos pires e no outro coloque fenol;
Em qual dos pires ocorrerá reação espontânea e consequente liberação de gás carbônico (CO2)? Considerando que Bicarbonato de sódio é um sal com caráter básico, e um dos ácidos é mais reativo do que o outro, espera-se que o pires contendo ácido carboxílico libere CO2 rapidamente.
Resultados: Realmente a reação não ocorre na presença de fenol, somente o ácido carboxílico provoca a formação de uma densa espuma esbranquiçada.
Através deste procedimento é possível provar a força ácida imposta pela constante de ionização.
Por Líria Alves
Graduada em Química
Equipe Brasil Escola
