PUBLICIDADE

Oxidar Etanol não parece ser uma atividade comum em nosso cotidiano, mas é justamente através desta reação química que é possível realizar uma operação policial muito importante no tráfego rodoviário: a identificação e retenção de motoristas alcoolizados.
Pesquisas apontam para os acidentes de trânsito como os principais causadores da morte precoce (até os 40 anos) em todo mundo. Em nosso país estima-se que na metade das ocorrências fatais há a presença de etanol no sangue das vítimas, e os principais envolvidos são jovens de 21 a 30 anos do sexo masculino.
Cabe à escola colaborar com as campanhas de combate ao alcoolismo, e para transformar esta ação em conteúdo disciplinar de Química, temos aqui uma sugestão: mostrar o funcionamento de um bafômetro através da oxidação do Etanol.
Material
5g de dicromato de potássio - K2Cr2O7(s)
24 mL de ácido sulfúrico (H2SO4) concentrado
50mL de água destilada H2O
Béquer de 100mL
proveta
pisseta contendo etanol

Béquer, proveta e pisseta.
Procedimento
1. Comece preparando a solução ácida: dissolva o dicramato de potássio em água e acrescente o ácido sulfúrico (com bastante cuidado). Coloque um pouco desta solução (de cor laranja) na proveta;
2. Introduza o bico da pisseta no recipiente contendo a solução de K2Cr2O7 e H2SO4;
3. Pressione a pisseta: neste momento os vapores de Etanol retidos serão transferidos para a proveta dando início à reação, identificada pela mudança de cor da solução;
4. Repita o procedimento até que a cor laranja inicial torne-se verde.
Equação do processo:
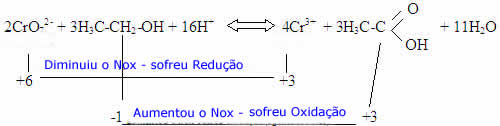
A solução K2Cr2O7/H+ é uma mistura oxidante que, ao reagir com o etanol, provocará sua oxidação a etanal.
Explicação química
O famoso “teste do bafômetro” se baseia na mudança de cor que ocorre na reação de oxidação do Etanol com dicromato de potássio em meio ácido. Na pisseta, uma parte do álcool está no estado de vapor, e quando ela é apertada, esse vapor entra em contato com a solução.
Neste caso, a pisseta simula o sopro do suspeito, se ele estiver realmente alcoolizado, a solução de dicromato mudará de cor, passando do laranja para o verde. Os modernos aparelhos ainda permitem determinar a quantidade exata de álcool no sangue.
Por Líria Alves
Graduada em Química
Equipe Brasil Escola





