Introdução:
O álcool utilizado principalmente na limpeza de materiais hospitalares e na limpeza doméstica não é o 96°GL, mas sim o 77°GL. O grau GL corresponde a graus Gay-Lussac, que indicam a quantidade a um litro de álcool puro (etanol) presente em cada 100 partes da solução. Por exemplo, nesse caso de 96°GL significa que em cada 100 mL, temos 96 mL de álcool e 4 mL de água.
Assim, esse valor é uma porcentagem em volume (96%v/v e 77%v/v). Agora, quando a porcentagem se refere à massa, a sigla utilizada é INPM (porcentagem de álcool em peso ou grau alcoólico). Assim, o álcool 77%v/v ou 77°GL corresponde a 70% m/m ou 70°INPM a 15°C. E 96%v/v (96°GL) corresponde a 92,8%m/m ou 92,8°INPM.

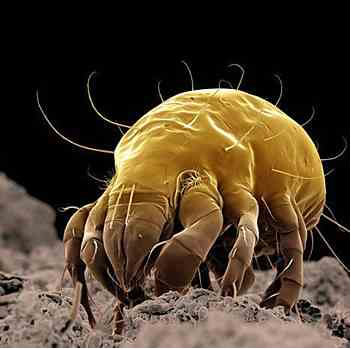
No entanto, o álcool 77%v/v é mais eficaz na limpeza doméstica e hospitalar, na desinfecção de superfícies fixas (como bancadas, vidrarias, equipamentos e utensílios) e também na antissepsia da pele, principalmente das mãos, do que o 96%v/v. Seu uso é necessário principalmente para a redução de ácaros, que são aracnídeos invisíveis a olho nu, mas que por se alimentarem de restos de pele estão muito presentes em locais poeirentos. Eles podem causar alergias e asma, daí a importância do uso do álcool 77% na limpeza, que reduz sua ocorrência.
Uma forma simples de se preparar essa solução hidroalcoólica é demonstrada nesse artigo e o professor pode realizá-lo em sala de aula ou em um Laboratório de Ciências, se a escola disponibilizar algum.
Essa aula experimental pode ser utilizada para desenvolver dois possíveis conteúdos, que são: “Diluição” e “Grupo funcional: Álcoois”. O primeiro conteúdo citado é usado no momento da transformação do álcool etílico 96% para 77%. Será necessário diluí-lo, segundo a fórmula da diluição de soluções (Cf. Vf = Ci . Vi).
Já o segundo conteúdo é ainda mais aconselhável, pois o álcool etílico (etanol) faz parte desse grupo funcional orgânico e é um conteúdo que normalmente vem depois de “Diluição” na grade curricular. Assim, subentende-se que os alunos já estão a par dos dois conteúdos.
Objetivo:
Preparar uma solução de álcool desinfetante (etanol 77%v/v) a partir de um álcool de concentração de 96%v/v, em que seu grau alcoólico real é de 94,7%v/v.
Materiais e Reagentes:
- Provetas;
- Bastão de vidro ou qualquer objeto para misturar;
- Frasco de 1 L (recomendável um balão volumétrico);
- 1 L de álcool doméstico (etanol 96%v/v);
- Água (de preferência destilada).
Procedimento Experimental:
1. Resfriar o álcool no congelador a uma temperatura igual ou aproximada a 15°C;
2. Calcular a quantidade de água e de álcool 96% que deve ser misturada para gerar uma concentração de 77%, ou 70% em massa. Isso é feito por meio da fórmula de diluição:
Cf. Vf = Ci . Vi
Onde:
Ci = Concentração inicial (concentração do álcool na solução pura)
Vi = Volume inicial (volume do álcool na solução pura)
Cf = Concentração final (concentração desejada)
Vf= Volume final (volume desejado)
Assim, temos:
Cf. Vf= Vi
Ci
77% . 1000 mL= Vi
94,7%
Vi = 813,09 mL
3. Medir essa quantidade de álcool com a proveta (813,09 mL) e transferir para o frasco de 1L;
4. Medir a quantidade de água necessária para completar 1000 mL ou 1L (186,9 mL) e misturar com o álcool.
5. Colocar um rótulo de identificação: “Álcool desinfetante 70%”. Sua validade é de cerca de 2 anos.
* Um álcool neutro 96°GL tem volume centesimal real de 94,7% e não de 96%, porque a tabela de força real dos líquidos espirituosos, ou seja, a tabela que indica o teor de grau alcoólico em misturas com água, é feita com instrumento graduado somente na temperatura de 15°C. Já o valor de 96% é dado em aproximadamente 21°C. Assim, é necessário conferir a tabela e colocar o valor contido lá, fazendo as devidas correções.
Por Jennifer Fogaça
Graduada em Química
