PUBLICIDADE

Introdução:
A densidade de uma substância é dada pela razão entre sua massa e o volume que ocupa.
Matematicamente é expressa pela equação:
![]()
Assim, uma substância menos densa flutua em uma mais densa e vice-versa. No entanto é possível alterar a densidade de uma substância se a misturarmos com outras. Por exemplo, o ovo afunda na água porque a água é menos densa que o ovo. Porém, se adicionarmos sal na água, a sua densidade aumentará e o ovo flutuará.
Mas será que é possível diminuir a densidade de algum material? Vejamos isso no experimento a seguir.
Material Necessário:
• Uvas-passas;
• Copo (pode ser um béquer ou qualquer recipiente parecido);
• Comprimido efervescente (pode ser em pó também);
• Água.
Procedimento Experimental:
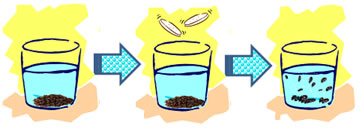
1. Corte as uvas-passas em tamanhos bem pequenos com uma tesoura;
2. Coloque-as em um copo com água pela metade;
3. Observe se as uvas afundaram ou flutuaram e relacione isso com sua densidade em relação à da água;
4. Adicione o comprimido ou o pó efervescente;
5. Observe o efeito ocorrido.
Resultados:
Num primeiro momento, as uvas-passas afundaram, pois a sua densidade era maior que a da água. Entretanto, ao se adicionar o comprimido efervescente, as uvas começaram a subir.
Porém, ao chegar à superfície elas voltam a descer. Este sobe e desce continua por um bom tempo.
Discussão:
O resultado descrito ocorre porque o gás liberado pelo comprimido é o CO2 (dióxido de carbono ou simplesmente gás carbônico), que possui a densidade muito menor que a da água. Assim, ao se fixar na uva-passa a densidade do conjunto “uva-passa + gás carbônico”, fica menor que a da água, por isso as uvas-passas começam a subir. Ao chegar à superfície o gás é liberado e a uva-passa volta a ter a densidade de antes, afundando novamente.
Esse processo será repetido continuamente, causando um efeito de sobe e desce das uvas-passas muito interessante, até que todo o gás seja liberado e as uvas afundem permanentemente.
Por Jennifer Fogaça
Graduada em Química
Equipe Brasil Escola





