Geralmente nas aulas sobre o conteúdo de geometria molecular surge certa dificuldade de assimilação por parte dos alunos. Isso ocorre principalmente porque se trata de um conteúdo mais teórico, que fica no “campo da imaginação”, por assim dizer, tendo em vista que não é possível ainda visualizar os átomos de forma isolada e/ou cada molécula formada pela união deles.
Assim, para minimizar esse efeito e ajudar os alunos a entenderem como os átomos das moléculas rearranjam-se no espaço de modo a formar diferentes estruturas, propomos aqui um recurso didático que pode ser utilizado em uma aula sobre geometria molecular.
A aula propõe a construção de modelos que representarão a geometria das moléculas a partir apenas de massa de modelar de cinco cores diferentes (preto, branco, azul, verde e vermelho) e palitos de dente. Essa atividade deve ser realizada após o conteúdo teórico de geometria molecular ter sido abordado com os alunos.
O professor pode dividir a turma em grupos de, no máximo, quatro alunos e orientá-los na construção dos modelos das moléculas que ele desejar. Aqui vamos propor a construção de quatro modelos:
* Peça que os alunos façam bolas (esferas) com as massinhas de modelar, de preferência que as coloridas fiquem ligeiramente maiores que as brancas.
* Oriente-os na construção dos modelos das moléculas do gás cloreto de hidrogênio (HCl), água (H2O), amônia (NH3) e metano (CH4).
- Cloreto de hidrogênio (HCl): Fale para os alunos ligarem uma bola branca (que representará o átomo de hidrogênio) com uma bola verde (que representará o átomo de cloro) através de um palito de dente. Ficará parecido com o mostrado a seguir:
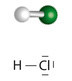
Estrutura do HCl
Para os demais modelos, peça que os alunos fixem quatro palitos de dente o mais distante possível uns dos outros nas esferas que representarão os átomos dos elementos centrais. A esfera vermelha representará o oxigênio, a esfera azul, o nitrogênio; e a esfera preta representará o hidrogênio.
- Água (H2O): Fale para os alunos colocarem duas esferas brancas (dois átomos de hidrogênio) em dois dos palitos ligados à esfera vermelha (oxigênio). Peça que eles deixem dois palitos livres. Ficará mais ou menos assim:
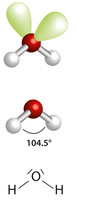
Estrutura da molécula de água
Não pare agora... Tem mais depois da publicidade ;)
- Amônia (NH3): Fale para os alunos colocarem três esferas brancas (três átomos de hidrogênio) em três dos palitos ligados à esfera azul (nitrogênio). Peça que eles deixem um dos palitos livre. Ficará parecido com o seguinte:
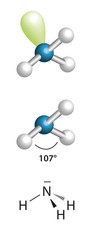
Estrutura da molécula de amônia
- Metano (CH4): Fale para os alunos colocarem quatro esferas brancas (quatro átomos de hidrogênio) em todos os palitos ligados à esfera preta (carbono). Ficará assim:
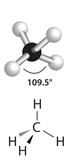
Estrutura da molécula do metano
Depois da construção de cada modelo, pergunte aos alunos qual foi a geometria molecular obtida em cada caso. As respectivas geometrias moleculares são:
* HCl:linear;
* H2O: angular;
* NH3: piramidal ou pirâmide trigonal;
* CH4: tetraédrica.
Os alunos verão com essa atividade que não existe a possibilidade de outro tipo de geometria para cada molécula e que os ângulos das ligações resultam da repulsão entre as nuvens eletrônicas dos átomos, que os deixam em um arranjo em que ficam o mais distante possível uns dos outros.
Pergunte também o que os palitos que ficaram livres nas estruturas da água e da amônia representam. Eles devem responder que são os pares de elétrons não compartilhados do átomo central. Por exemplo, no caso da água, o elemento central é o oxigênio, que possui seis elétrons na camada de valência. Desses seis elétrons, ele compartilha dois, um com cada átomo de hidrogênio, segundo a regra do octeto. Assim, sobram quatro elétrons que não são compartilhados, ou seja, dois pares.
Esses dois pares formam duas nuvens eletrônicas que se repelem e repelem os elétrons das ligações com os hidrogênios. É por isso que a água não possui geometria linear (ângulo de 180º), como o HCl, mas sim geometria angular, ou seja, forma-se um ângulo de 104, 5º.
Já no caso da molécula de amônia, há um palito livre porque o nitrogênio fica com um par de elétrons livres (não compartilhados) que repele os elétrons das ligações com os três átomos de hidrogênio. Assim, a geometria dessa molécula é piramidal ou pirâmide trigonal.
Por Jennifer Fogaça
Graduada em Química










