Introdução:
Os óxidos são compostos binários, ou seja, que possuem somente dois elementos químicos, sendo que o mais eletronegativo entre eles é o oxigênio.
Os óxidos podem ser classificados em diversos tipos de acordo com o seu comportamento na presença de água. Detalhes sobre esse tipo de classificação você poderá ver no texto Classificação dos óxidos.
Este texto pretende trazer um experimento bastante interessante que pode ser aplicado em sala de aula pelo professor para que os alunos possam conhecer melhor os óxidos, principalmente os óxidos básicos e os ácidos.
Os óxidos básicos são aqueles que reagem com a água, originando uma base, e com ácidos, originando sal e água como produtos. Por outro lado, os óxidos ácidos reagem com a água, originando um ácido, e com bases, originando sal e água como produtos.
O CaO (óxido de cálcio) é um exemplo de óxido básico, que é conhecido como cal viva, cal virgem ou simplesmente cal. Misturado com a água, ele forma a cal hidratada que é usada para pinturas de caiação. Sobre a cal hidratada, falaremos mais nas partes sobre Resultados e Discussão deste texto.
O CO2 (dióxido de carbono) é um óxido ácido e ele está presente em diversas partes do nosso cotidiano. Por exemplo, ele é o gás dissolvido em refrigerantes e em águas, sendo submetido a altas pressões.
Materiais e reagentes:
-
Dois frascos de vidro com tampas (tais como os potes de azeitonas, palmitos e maionese);
-
Uma colher de plástico;
-
Água com gás bem tampada;
-
Água sem gás (pode ser da torneira);
-
Cal virgem (encontrada em lojas de material de construção);
-
Canudo;
-
Indicador fenolftaleína (solução alcoólica de fenolftaleína 1% m/v. A fenolftaleína pode também ser preparada a partir da trituração de 1 comprimido de Lacto-purga® e adição de 50 mL de álcool hidratado. Basta mexer até que não haja mais dissolução.).
Procedimento experimental:
-
Coloque 250 mL de água com gás em um dos frascos de vidro;
-
Adicione 1,5 g de cal virgem e feche rapidamente;
-
No outro frasco, coloque 2,5 mL de água sem gás e também adicione 1,5g de cal, fechando em seguida;
Não pare agora... Tem mais depois da publicidade ;)
-
Agite bem os dois frascos para que ocorra a homogeneização das duas soluções;
-
Deixe em repouso por 10 minutos e observe o que acontece;
-
Depois de anotar os resultados observados, agora você fará o seguinte: adicione algumas gotas do indicador fenolftaleína nas duas soluções e veja o que acontece;
-
Agora, usando o canudo, assopre na solução formada com a água sem gás e novamente veja se há alguma alteração.
Resultados e Discussão:
Depois que os dois frascos são deixados em repouso, observa-se que o que está com a água sem gás fica com o aspecto leitoso, ou seja, forma um líquido branco turvo. Isso acontece porque, visto que o óxido de cálcio (CaO) é um óxido básico, quando ele entra em contato com a água, forma-se uma base, que é o hidróxido de cálcio (cal hidratada), que é o líquido branco observado:
CaO(s) + H2O(ℓ) → Ca(OH)2(aq)
Essa reação também ocorre no frasco que tem a água com gás. Porém, também ocorrem outras reações nesse frasco, porque o gás carbônico dissolvido é um óxido ácido, que reage com a água, formando o ácido carbônico:
CO2(g) + H2O(ℓ) → H2CO3(aq)
O ácido carbônico, por sua vez, reage com o hidróxido de sódio formado, em uma reação de neutralização, formando um sal (carbonato de cálcio) e água:
H2CO3(aq) + Ca(OH)2(aq) → CaCO3(aq) + 2 H2O(ℓ)
O sal é o precipitado que se acumula no fundo do recipiente e, por isso, o líquido fica incolor.
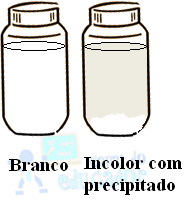
Quando se adicionou a fenolftaleína nas duas soluções, ficou perceptível que uma delas ficou rósea, enquanto a outra ficou incolor. Isso acontece porque a fenolftaleína é um indicador ácido-base que, em meio básico, fica rosa bem intenso; enquanto, em meio ácido e neutro, permanece incolor.
Quando assopramos na solução de água sem gás, ela adquire coloração incolor novamente. Isso acontece porque na nossa respiração o oxigênio é transformado em CO2, que entra em contato com a água, tornando o meio ácido.
Por Jennifer Fogaça
Graduada em Química







