O butano é um composto orgânico da família do grupo dos hidrocarbonetos, cuja fórmula molecular é C4H10.
O butano é o combustível dos isqueiros descartáveis, e é um dos principais componentes do gás liquefeito de petróleo (GLP), que é uma das frações obtidas nas refinarias de petróleo. Ele é chamado de liquefeito porque dentro dos botijões, por exemplo, ele é comprimido por altas pressões e parte dele passa para o estado líquido, o que podemos “sentir” balançando um botijão ou mesmo vendo um isqueiro de material transparente, como o mostrado na imagem no início do texto.
No experimento a seguir será mostrado como podemos determinar a massa molar do gás butano, de acordo com a Lei dos Gases Perfeitos.
Materiais necessários:
- 1 isqueiro;
- Balança;
- Mangueira transparente;
- Água;
- Proveta de 250 mL;
- Um recipiente de vidro ou transparente;
- Termômetro.
Procedimento Experimental:
1. Pese a massa inicial do isqueiro;
Conecte a mangueira na saída do isqueiro, de modo a não deixar nenhum vazamento, pois se a conecção do tubo ao isqueiro vazar, seus resultados estarão errados;
2. Coloque água no recipiente transparente;
3. Encha a proveta com água, tampe a sua abertura, a inverta e coloque-a no recipiente com água;
4. Pegue a extremidade livre da mangueira e coloque no interior da proveta;
5. Determine a temperatura da água;
6. Injete o gás, ao apertar lentamente o gatilho do isqueiro, e observe o que ocorre;
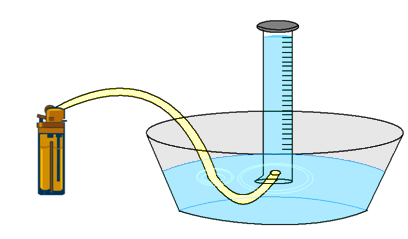
7. Faça a leitura do volume do gás coletado na proveta e anote;
8. Pese novamente o isqueiro e anote a massa obtida;
9. Repita o experimento 3 vezes para obter uma média nas medidas.
ATENÇÃO: Professor, lembre aos alunos que o gás butano é tóxico e, se for inalado, pode causar arritmia cardíaca e bradicardia (diminuição da frequência dos batimentos do coração). Além disso, deixe as janelas do laboratório abertas.
Resultados e Discussão:
Quando o gás butano é injetado na proveta, ocorre um deslocamento da coluna de água em seu interior.
O professor pode pedir para os alunos calcularem a massa molar (M = m/n) do gás butano, com o auxílio da equação de estado dos gases (PV = nRT). Considere o gás butano como um gás ideal, a pressão atmosférica (P) igual a 1 atm e o valor da constante universal dos gases (R) igual a 0,082 atm. L. K1- . mol1-.
Veja um exemplo:
Digamos que os dados obtidos foram:
Massa do isqueiro antes (m1) = 18, 7 g
Massa do isqueiro depois (m2) = 18, 5 g
Volume deslocado de água na proveta (V) = 71 mL
Temperatura medida na hora do experimento = 28 ºC
Relacionando a equação de estado dos gases (PV = nRT) com fórmula da massa molar (M = m/n → n = m/M ) , temos:
M = mRT
PV
P = Pressão (Pressão atmosférica menos a pressão de vapor da água);
V: Volume;
n: número de mols;
m: massa do butano (m1 – m2 = 18,7 – 18,5 = 0,2);
M: massa molar do butano;
R: Constante dos gases;
T: temperatura em graus Kelvin (28 + 273,15 = 301,15 K)
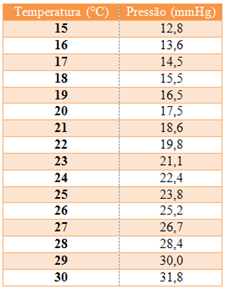
Para descobrir a pressão de vapor da água basta olhar na tabela a seguir. Visto que a temperatura medida foi de 28 ºC, então a pressão de vapor de água na coluna é de 28,4 mmHg.Concluímos que a pressão exercida pelo gás na coluna d’água dentro da proveta foi de 731,6 mmHg. Já que se considera que a pressão atmosférica no momento do experimento era de 1 atm ou 760 mmHg.
Agora que temos todos os dados podemos substituí-los na fórmula e descobrir a massa molecular o gás butano:
M = mRT
PV
M = (0,2 g) . (0,082 atm . L . K-1 . mol-1) . (301,15 K)
(0,962 atm) (71 . 10 -3 L)
M ≈ 72,3 g/mol
A massa molecular do gás metano é de 58 g/mol. Os dados obtidos experimentalmente não foram iguais aos teóricos, provavelmente devido a erros de operação, tais como presença de ar na proveta e a perda de massa de gás butano.
O professor pode pedir aos alunos que apontem qual foi a possível fonte de erro em seus experimentos.
Por Jennifer Fogaça
Graduada em Química

