Introdução:
Os polímeros são macromoléculas orgânicas (moléculas gigantes) formadas pela união sucessiva de monômeros (moléculas orgânicas pequenas). Entre os tipos de polímeros existentes, temos as borrachas, que podem ser naturais ou sintéticas.
As borrachas naturais são obtidas por meio do látex, secreção da seringueira (Hevea brasiliensis) que tem aspecto leitoso (líquido branco). O monômero que compõe a borracha natural é o isopreno, mostrado abaixo:

No entanto, essa borracha é muito quebradiça em dias frios e extremamente gosmenta em dias quentes. Assim, para se tornar útil para a fabricação dos mais diversos objetos, a borracha passa pelo processo de vulcanização, onde a sua estrutura é modificada. Átomos de enxofre são adicionados e unem as estruturas lineares iniciais do látex, formando pontes de enxofre que aumentam a resistência e a dureza da borracha.
Ao considerar esse assunto em sala de aula, o professor pode enfatizar para os alunos como é possível modificar a estrutura de um polímero por meio de uma atividade prática. O experimento a seguir é considerado muito divertido, pois o polímero que será obtido terá um aspecto gosmento, chamado por muitos de “geleca”, e o aluno poderá manipular.
Materiais e Reagentes:
- Luvas de proteção individual;
- Cola branca;
- Bórax (pode ser adquirdo em farmácias);
- Corante alimentício (pode ser anilina);
- Água;
- 1 colher de café de plástico;
- 3 copos descartáveis grandes (usados para suco);
- 3 copos descartáveis pequenos (usados para café);
- 1 palito de sorvete.
Procedimento:
A primeira coisa a ser feita é produzir uma solução aquosa de bórax com título aproximado de 0,04 ou 4% em massa.
Mas é importante lembrar que o bórax é o tetraborato de sódio deca-hidratado (Na2B4O7 . 10 H2O), que é um material perigoso porque pode causar irritação na pele e nas mucosas. Por isso, o uso de luvas é imprescindível. Se o professor preferir, ele mesmo pode preparar essa solução e levar já pronta para seus alunos.

- Coloque dois copos pequenos (para café) de água no copo grande. Isso corresponderá a cerca de 100 mL de água;
- Adicione uma colher de café de boráx, não muito cheia, na água que está no copo grande;
- Mexa bem e reserve essa solução;
- Coloque um copo pequeno de água e um copo pequeno de cola branca em outro copo grande;
- Adicione o corante da cor de sua preferência;
- Misture bem com o palito de sorvete;
- Observe a consistência dessa solução;
- Coloque no terceito copo grande a mesma medida (utilize o copo pequeno) da solução de bórax e da solução de cola;
- Misture bem com o palito de sorvete;
- Observe a consistência da mistura obtida. Agora você pode tocar e manusear como quiser o polímero obtido.
Resultados e Discussão:
Não pare agora... Tem mais depois da publicidade ;)
O polímero obtido mudou bastante de consistência, tornando-se muito elástico, de aspecto gosmento. É a rigor uma massa colorida com comportamento de fluido não newtoniano, isto é, sua viscosidade não é constante e depende da força a que está submetida. Apresenta características de líquido (como adquirir a forma do recipiente e escorrer) e também de sólido (como se romper quando esticado com força e bruscamente).

Quando colocamos o bórax em água para formar a solução, ele é dissociado e se obtém o ânion [B(OH)4]-, conforme o equilíbrio químico mostrado abaixo:
Na2B4O7 . 10 H2O + aq ⇔ 2 H3BO3(aq) + 2 Na+(aq) + 2 B(OH)4-(aq) + 3 H2O(l)
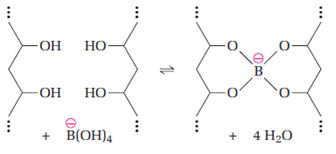
Assim, quando misturamos essa solução com a cola branca, esse ânion estabelece ligações de hidrogênio com as macromoléculas de PVA, formando uma estrutura única, onde as moléculas de água ficam retidas.
Observe na imagem abaixo que antes as moléculas eram linerares, mas agora o polímero tem ligações cruzadas entre suas cadeias, semelhantes a pontes de enxofre existentes na borracha vulcanizada. Essas ligações cruzadas são constantemente feitas e desfeitas.
Se o aluno quiser guardar a “geleca” para manipular depois será preciso guardar num recipiente plástico com tampa ou num saco plástico fechado, pois visto que não se usou um conservante, a água que ficou retida na estrutura tenderá a evaporar e a massa ficará mais ressecada e quebradiça.
Por Jennifer Fogaça
Graduada em Química










