Quando a reação química ocorre em meio aquoso com as espécies químicas dissociadas, pode-se representar esse tipo de reação por meio de equações iônicas. Por exemplo, numa solução aquosa de cloreto de sódio (NaCℓ(aq)) existem os íons Na+(aq) e Cℓ-(aq). Já na solução aquosa de nitrato de prata (AgNO3(aq)) há os íons Ag+(aq) e NO3-(aq). Se misturarmos essas duas soluções, os íons Ag+(aq) do nitrato de prata irão reagir com os íons Cℓ-(aq) do cloreto de sódio, formando o precipitado cloreto de prata (AgCℓ(s)):
NaCℓ(aq) + AgNO3(aq) → AgCℓ(s) + NaNO3(aq)
A equação iônica completa é dada por:
Na+(aq) + Cℓ-(aq) + Ag+(aq) + NO3-(aq) → AgCℓ(s) + Na+(aq) + NO3-(aq)
Simplificadamente, temos:
Ag+(aq) + Cℓ-(aq) → AgCℓ(s)
Esse fenômeno é denominado de precipitação.
A tabela de solubilidade é usada para verificar se na reação ocorrerá ou não uma precipitação, porque ela permite prever quais os íons que, em solução aquosa, combinam-se para formar um precipitado.
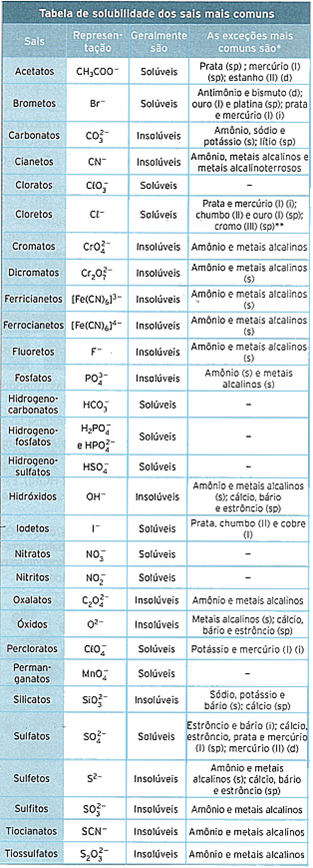
*sp: solúvel parcialmente; d: decompõem-se em água; i: insolúvel; s: solúvel.
**Muito lentamente.
No caso do exemplo acima, se você olhar na tabela, verá que na linha que se refere aos cloretos (Cℓ-) a grande maioria é solúvel em solução aquosa. Mas entre as principais exceções está o cloreto de prata, que é insolúvel. Isso significa que esse será um precipitado.
Com base nisso, o experimento a seguir pode ser feito com os alunos com a finalidade de fornecer prática na previsão dos resultados de reações, verificação desses resultados e sua interpretação.
Isso significa que os alunos deverão prever se haverá a ocorrência da reação química entre os íons das soluções que serão misturadas. Isso será evidenciado pela formação de um precipitado.
Antes de realizar o experimento, o professor pode pedir que os alunos indiquem quais serão as reações que ocorrerão com base na tabela de solubilidade e, em seguida, escrevam as equações químicas balanceadas que representam essas reações.
- Solução de hidróxido de sódio 0,1 mol/L;
- Solução de hidróxido de cálcio (água de cal);
- Solução de nitrato de magnésio 0,1 mol/L;
- Solução de carbonato de sódio 0,1 mol/L;
- Solução de sulfato de cobre (II) 0,1 mol/L;
- 10 tubos de ensaio;
- Estante para tubos de ensaio;
- Canetinha;
- Conta-gotas para cada solução.
- Procedimento experimental:
Com a canetinha enumere os tubos de ensaio de 1 a 10 e realize as seguintes misturas especificadas abaixo, colocando cerca de 3 mL de cada solução e agitando posteriormente:
Não pare agora... Tem mais depois da publicidade ;)
- Tubo 1: Hidróxido de sódio + sulfato de cobre (II);
- Tubo 2: Hidróxido de sódio + carbonato de sódio;
- Tubo 3: Hidróxido de sódio + nitrato de magnésio;
- Tubo 4: Hidróxido de sódio + hidróxido de cálcio;
- Tubo 5: Hidróxido de cálcio + sulfato de cobre (II);
- Tubo 6: Hidróxido de cálcio + carbonato de sódio;
- Tubo 7: Hidróxido de cálcio + nitrato de magnésio;
- Tubo 8: Nitrato de magnésio + sulfato de cobre (II);
- Tubo 9: Nitrato de magnésio + carbonato de sódio;
- Tubo 10: Carbonato de sódio + sulfato de cobre (II).
Os alunos devem verificar se os resultados observados confirmam o que eles previram no início. A formação de precipitado indicará a ocorrência das reações entre íons das soluções misturadas.
Por exemplo, no tubo 1, temos:
2 NaOH(aq) + CuSO4 → Na2SO4(aq) + Cu(OH)2(s)
Pela tabela vemos que os sulfatos (SO42-) são solúveis. O sulfato de sódio não é uma das exceções, assim ele não forma um precipitado. Já os hidróxidos (OH-) são insolúveis, por isso o hidróxido de cobre é um precipitado.
Assim, temos:
2 Na+(aq) + 2 OH-(aq) + Cu2+(aq) + SO42-(aq) → Cu(OH)2(s) + 2 Na+(aq) + SO42-(aq)
Ou, mais simplificadamente:
Cu2+(aq) + 2 OH-(aq) → Cu(OH)2(s)
Na prática, os alunos deverão observar a formação do precipitado azul de hidróxido de cobre.
A mesma análise deve ser feita para todas as misturas.
Por Jennifer Fogaça
Graduada em Química







