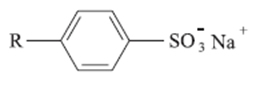
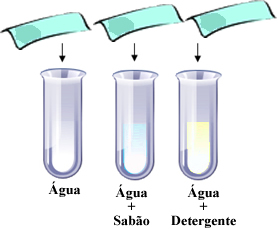
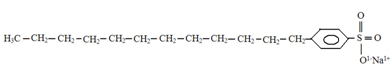Artigos relacionados
Estratégias de ensino-aprendizagem
Bolha de sabão mais resistente
Quer saber o segredo para se obter bolhas de sabão grandes e que demoram a estourar? Então leia esse texto e veja que a resposta está relacionada...
Estratégias de ensino-aprendizagem
Fazendo Sachês Perfumados
Aprenda a fazer sabonetes e sachês perfumados para vender, dar como presente, enfeitar e aromatizar objetos pessoais, armários, sapatos e roupas.
Estratégias de ensino-aprendizagem
Fazendo sabonete
Aprenda a fazer e saiba qual a química envolvida no processo.
Estratégias de ensino-aprendizagem
Fazendo sabão
Uma sugestão para a Feira de Ciências.
Estratégias de ensino-aprendizagem
Transformando óleo de cozinha usado em sabão
Aula interdisciplinar de Química e Ecologia.