Artigos relacionados
Estratégias de ensino-aprendizagem
Corrosão
Acompanhe a propriedade do ferro de se enferrujar.
Estratégias de ensino-aprendizagem
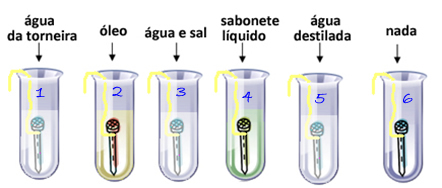
Formação da ferrugem
Experimento sobre a oxidação.
Estratégias de ensino-aprendizagem
Maresia e Oxirredução
Transformações químicas que ocorrem em metais à beira mar.
Estratégias de ensino-aprendizagem
Oxidação de moedas
Demonstração prática de como as moedas se oxidam.
Estratégias de ensino-aprendizagem
Palhas de aço e ferrugem
Demonstre de uma forma simples a formação da ferrugem.
Estratégias de ensino-aprendizagem
Pilhas caseiras
Existem vários tipos de pilhas que você pode construir em casa ou na escola para observar a transferência de elétrons. Nesse texto, você...
Estratégias de ensino-aprendizagem
Uma pilha parecida com a pilha de Daniell
Construa com seus alunos uma pilha semelhante à pilha de Daniell que pode ajudar a consolidar os conceitos estudados em eletroquímica.