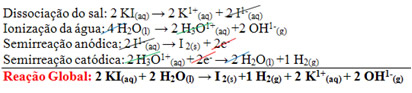Artigos relacionados
Estratégias de ensino-aprendizagem
Aula prática: restaurando objetos de Prata
Qual solução usar para limpar materiais oxidados.
Estratégias de ensino-aprendizagem
Cobre puro através da eletricidade
O refino eletrolítico do cobre
Estratégias de ensino-aprendizagem
Cobreação
Um experimento de eletrólise de fácil realização é o da cobreação de uma chave.
Estratégias de ensino-aprendizagem
O assunto é: Eletrólise
Processo químico provocado por corrente elétrica.