A glicose e a frutose são substâncias da família dos glicídios ou carboidratos que, conforme mostra a figura abaixo, possuem a mesma fórmula molecular (C6H12O6), mas se diferenciam pela estrutura. Veja que a glicose é um poliálcool-aldeído e a frutose é um poliálcool-cetona.
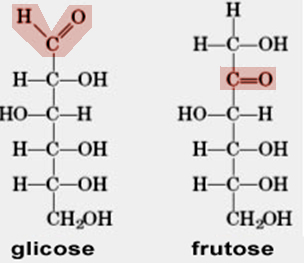
Se tivéssemos a fórmula C6H12O6 escrita no rótulo de um frasco contendo um líquido incolor, como faríamos para descobrir se essa determinada solução é a glicose ou a frutose?
Bom, quando expostos a oxidantes fracos, os aldeídos são oxidados, mas as cetonas não. Por meio de uma reação assim, podemos diferenciar os aldeídos das cetonas e, nesse caso, diferenciar a glicose da frutose, isto é, se reagir, é um aldeído (glicose); se não acontecer nada, é uma cetona (frutose).
Uma solução que atua como um oxidante fraco e que só os aldeídos reagem é o reativo de Tollens, que é uma solução de nitrato de prata amoniacal.
O aldeído é oxidado ao ácido carboxílico correspondente, enquanto os íons prata são reduzidos à Ag0 (prata metálica). Se essa reação for realizada, por exemplo, em um tubo de ensaio, essa prata metálica se depositará nas paredes do tubo, resultando na formação de uma película chamada de espelho de prata. Esse resultado observado é muito bonito.
A reação que ocorre pode ser representada da seguinte maneira:
O O
║ ║
R ─ C ─ H + H2O → R ─ C ─ OH + 2e- + 2 H+
2 Ag+ + 2e- → 2 Ag0
2 NH3 + 2 H+ → 2 NH4+
O O
║ ║
R ─ C ─ H + 2 Ag+ + 2 NH3 +H2O → R ─ C ─ OH + 2 Ag0 + 2 NH4+
aldeído reativo de Tollens ácido carboxílico prata metálica (espelho de prata)
O professor pode realizar esse experimento em sala de aula conforme explicado a seguir:
Materiais e Reagentes:
- Dextrosol (glicose);
- Ácido tartárico e hidróxido de sódio (somente para o segundo modo desse experimento);
- Nitrato de prata (encontrado em farmácias);
- Amoníaco (solução à base de amônia encontrada em supermercados e também em farmácias. Se preferir, pode preparar essa solução dissolvendo 6,0 g de nitrato de amônio em 50 mL de água destilada);
- Água destilada;
- Tubo de ensaio ou balão de fundo chato com rolha;
- Álcool;
- Pinça de madeira e lamparina (somente para o primeiro modo desse experimento);
- Conta-gotas;
- Proveta;
- Uma colher de chá.
Procedimento experimental:
Não pare agora... Tem mais depois da publicidade ;)
Esse experimento pode ser feito de duas formas. A vantagem da primeira forma é que menos reagentes são utilizados. A vantagem da segunda é que não é necessário aquecer a mistura, basta misturá-la. Veja como é feita cada uma para você decidir qual será a melhor no seu caso:
1º Modo de realizar esse experimento:
- Prepare uma solução aquosa de nitrato de prata dissolvendo 4,0 g desse soluto em 50 mL de água destilada;
- Coloque uma colher de chá de dextrosol (glicose) dentro do tubo de ensaio;
- Adicione 10 mL do reativo de Tollens;
- Acrescente mais 10 gotas de amoníaco;
- Segurando o tubo de ensaio com a pinça, leve-o ao aquecimento direto na lamparina, mantendo sempre a agitação;
- Pare o aquecimento quando o espelho de prata formar-se nas paredes do tubo de ensaio.
2º Modo de realizar esse experimento:
- Prepare uma solução aquosa de nitrato de prata dissolvendo 4,0 g desse soluto em 50 mL de água destilada;
- Prepare separadamente outra solução dissolvendo a glicose em 50 mL de água destilada. Depois, acrescente 0,6 g de ácido tartárico e ferva a solução. Depois de esfriar, adicione a essa solução 10 mL de etanol (álcool etílico) e dilua com água até atingir o volume de 100 mL. Para tal, você poderá usar um balão volumétrico de 100 mL;
- Prepare mais uma solução diluindo 5,0 g de hidróxido de sódio em 50 mL de água;
- Misture 10 mL da solução aquosa de nitrato de prata e 10 mL do amoníaco;
- Agora usando o balão de fundo chato ou um erlenmeyer, coloque essa última mistura dentro dele e acrescente 20 mL da solução aquosa de nitrato de prata e 20 mL da solução de hidróxido de sódio;
- Feche com a rolha e agite, misturando a solução de forma lenta, mas, sem parar, rodando a solução no fundo do frasco;
- Observe a formação do espelho de prata nas paredes do interior do recipiente.
Resultados e Discussão:
O professor pode pedir aos alunos que equacionem a reação que ocorre e que exercitem conceitos do conteúdo de reações de oxirredução ao perguntar se a prata se reduziu ou se oxidou, se ela é o agente redutor ou o agente oxidante. E o grupo aldeído presente na glicose? Reduziu ou oxidou? É o agente redutor ou o agente oxidante?
Por Jennifer Fogaça
Graduda em Química








