Esta proposta de aula prática sobre complexos de cobre é uma alternativa de facilitação do aprendizado, já que a teoria que explica a formação de complexos não é de fácil compreensão.
Os complexos de cobre são macromoléculas (moléculas grandes) nas quais um átomo de cobre interage com vários átomos, íons ou moléculas. Na proposta de aula prática, serão abordadas as formações de complexos de cobre nas quais o átomo de cobre interage com os seguintes materiais:
-
Amônia
-
Glutamato
-
Cloro
-
Ureia
Além de uma melhor compreensão sobre a formação de complexos químicos, a proposta de aula prática sobre complexos de cobre é interessante também para realizar o estudo dos seguintes assuntos de Química:
Materiais e reagentes
-
1 béquer de 150 mL
-
5 béqueres de 50 mL
-
1 pipeta
-
1 pera de sucção
-
1 conta-gotas
-
6 baquetas
-
Água
-
30 mL de vinagre
-
50 mL de ácido clorídrico
-
20 g de glutamato monossódico (pode ser encontrado em temperos Ajinomoto)
-
2 g de bicarbonato de amônio
-
2 g de ureia
-
2 g de hidróxido de sódio
Procedimentos
a) Para o preparo da solução de cobre
-
Passo 1: Pesar cerca de 10 gramas de sulfato de cobre na balança;
-
Passo 2: Medir 100 mL de água em um béquer;
-
Passo 3: Adicionar todo o sulfato de cobre ao béquer com água. Agitar bastante para dissolver bem o sal. Essa solução será chamada de solução de cobre.

Representação do resultado final do preparo de uma solução aquosa de sulfato de cobre
b) Para a complexação de cobre com amônia (NH3)
-
Passo 1: Pesar 1 g de bicarbonato de amônio (NH4HCO3) na balança;
-
Passo 2: Medir 30 mL de água em um béquer;
-
Passo 3: Adicionar todo o bicarbonato de amônio à água. Em seguida, agitar bem até dissolvê-lo;
-
Passo 4: Acrescentar 2,5 mL da solução de cobre no béquer com a mistura bicarbonato e água;
-
Passo 5: Gotejar ácido clorídrico até que haja uma mudança de coloração.

Representação do resultado final do preparo de uma solução de cobre e bicarbonato
c) Para a complexação do cobre com o glutamato
-
Passo 1: Pesar 1 g de glutamato monossódico na balança;
-
Passo 2: Medir 20 mL de água em um béquer;
-
Passo 3: Adicionar todo o glutamato monossódico à água. Em seguida, agitar bem até dissolvê-lo;
-
Passo 4: Acrescentar 2,5 mL da solução de cobre no béquer com a mistura glutamato monossódico e água.

Representação do resultado final do preparo de uma solução de ácido e glutamato monossódico
d) Para a formação do complexo cobre e cloro
-
Passo 1: Medir 2,5 mL da solução de sulfato de cobre em um béquer;
-
Passo 2: Medir 10 mL de água em um béquer e, em seguida, transferi-lo;
-
Passo 3: Gotejar ácido clorídrico até que haja uma mudança de cor permanente da solução.
Não pare agora... Tem mais depois da publicidade ;)

Representação do resultado final do preparo de uma solução de cobre e cloro
e) Preparação da solução de hidróxido de sódio
-
Passo 1: Medir 30 mL de água em um béquer;
-
Passo 2: Pesar 2 gramas de hidróxido de sódio (NaOH);
-
Passo 3: Adicionar o hidróxido de sódio ao béquer com água e agitar até dissolvê-lo.

Representação do resultado final do preparo de uma solução aquosa de hidróxido
f) Para a preparação do complexo de cobre e ureia
-
Passo 1: Pesar 2 gramas de ureia;
-
Passo 2: Medir 20 mL de água em um béquer;
-
Passo 3: Adicionar toda a ureia ao béquer com água e agitar até dissolvê-lo;
-
Passo 4: Adicionar três gotas da solução de cobre ao béquer.

Representação do resultado final do preparo de uma solução de cobre e ureia
Explicação dos resultados alcançados em cada procedimento
→ Na letra a do procedimento, temos a ocorrência da dissociação do sulfato de cobre na água.
CuSO4 → Cu+2 + SO4-2
→ Na letra b, quando o bicarbonato de amônio é dissolvido em água, sofre decomposição, formando o gás amônia (NH3), que interage com o cobre e forma o complexo.
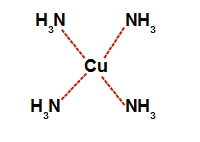
Representação da estrutura do complexo de cobre e amônia
→ Na letra c do procedimento, o glutamato monossódico (Ajinomoto), ao ser dissolvido em água, dissocia-se e libera o cátion sódio e o ânion glutamato. Esse ânion glutamato interage com o átomo de cobre para a formação do complexo de cobre e glutamato.
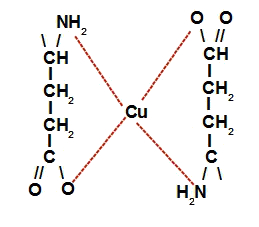
Representação da estrutura do complexo de cobre e glutamato
→ Na letra d, quando o ácido clorídrico é misturado com a água, ele se ioniza, formando cátions hidrônio e ânions cloreto (Cl-). Os ânions cloreto interagem com o átomo de cobre, formando o complexo de cobre e cloro.
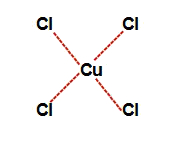
Representação da estrutura do complexo de cobre e cloro
→ Na letra e, temos a dissociação do hidróxido de sódio em água, fenômeno esse que libera calor.
NaOH + H2O → Na+ + OH-
→ Na letra f, quando o sulfato de cobre é misturado com a solução catalisada de ureia, temos a interação de moléculas da ureia com o átomo de cobre, formando o complexo de cobre e ureia.
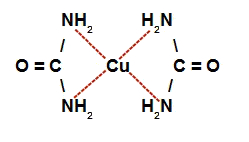
Representação da estrutura do complexo de cobre e ureia
Por Me. Diogo Lopes Dias
















