Trabalhar reações orgânicas de oxidação com os alunos de Ensino Médio é importante, já que se trata de um processo químico relacionado com o cotidiano do ser humano. Um exemplo disso é a oxidação do betacaroteno, reação que leva à produção da vitamina A (retinol).
Neste artigo apresentamos uma proposta de atividade prática sobre a oxidação de compostos orgânicos para que o aprendizado sobre essas reações não fique restrito apenas à montagem de equações químicas no quadro ou caderno. Essa proposta tem por objetivo tornar o aprendizado mais prazeroso e contextualizado.
Para que a reação de oxidação ocorra, é necessária a utilização de um bom agente oxidante (substância que sofre redução e provoca oxidação em outra). Para isso, faremos uso do reagente de Baeyer, ou seja, uma solução com Permanganato de Potássio (KMnO4) dissolvido em água.
Quando dissolvido em água, o Permanganato de Potássio sofre dissociação, liberando cátions potássio (K+) e ânions permanganato (MnO4-1) no meio:
KMnO4 + H2O → K+ + MnO4-1
O íon permanganato dá uma coloração lilás à solução. Quando ele sofre redução, dependendo do meio em que estiver, pode ser transformado em dióxido de manganês - MnO2 (se o meio for básico) ou Monóxido de Manganês - MnO (se o meio for ácido).
Quando o MnO2 é formado, a solução apresenta uma coloração marrom avermelhada. Já o MnO não modifica a coloração da solução.
OBS.: Independentemente da coloração, devemos lembrar que é a partir do KMnO4 que surgem os oxigênios nascentes fundamentais para a ocorrência das oxidações.
Proposta prática para o ensino sobre reações de oxidação:
Materiais necessários:
- 1 comprimido ou flaconete de permanganato de potássio (adquirido em farmácias);
- 270 mL de água;
- 1 cenoura pequena;
- Óleo de soja;
- 2,5 mL de álcool líquido (etanol hidratado adquirido em farmácia ou supermercado);
- 2,5 mL de formaldeído - Formol (adquirido em lojas especializadas em reagentes químicos e laboratoriais);
- 1 liquidificador;
- 1 peneira fina;
- 5 béqueres de 50 mL;
- 1 béquer de 500 mL.
Sugestão de procedimento
Quando for aplicar essa atividade, você pode optar entre fazer a demonstração aos alunos ou pedir para que eles a executem. Se optar por colocar os alunos para realizar, terá que adequar as quantidades dos materiais necessários.
Os passos sugeridos para o desenvolvimento do experimento são:
-
1o Passo: Adicionar 20 mL de água no interior de um dos béqueres de 50 mL juntamente ao conteúdo de um flaconete de permanganato de potássio. Caso tenha o permanganato em forma de comprimido, é interessante pulverizá-lo no cadinho para facilitar a dissolução. Agite a mistura até que todo o sal dissolva-se. A mistura preparada nesse passo será chamada de solução 1.
-
2o Passo: Colocar 250 mL de água no interior do liquidificador e, em seguida, adicionar a cenoura. Bata até que a cenoura fique bem triturada. Em seguida, peneire o suco preparado diretamente no béquer de 250 mL. O suco de cenoura peneirado será chamado de solução 2.
OBS.: Para observar se houve ou não alguma alteração, é interessante colocar 20 mL da solução 1 em um béquer e posicioná-lo ao lado do outro que recebeu a solução 2 misturada com a solução 1.
-
4o Passo: Adicionar em um béquer 30 mL de óleo de soja e 2,5 mL da solução 1. Agite bem e aguarde pelo menos 15 minutos para avaliar se houve ou não alguma alteração.
Não pare agora... Tem mais depois da publicidade ;)
-
5o Passo: Adicionar em um béquer 2,5 mL de álcool hidratado e 2,5 mL da solução 1. Agite bem, aguarde e observe se houve ou não alguma alteração.
-
6o Passo: Adicionar em um béquer 2,5 mL de formaldeído e 2,5 mL da solução 1. Agite bem, aguarde e observe se houve ou não alguma alteração.
Discussão
É interessante que cada professor possa ressaltar pontos pertinentes à oxidação de compostos orgânicos, que deve ter sido estudada de forma teórica anteriormente.
No experimento foram provocadas oxidações de quatro substâncias diferentes. A partir daí, use a sua criatividade a partir dos seguintes aspectos:
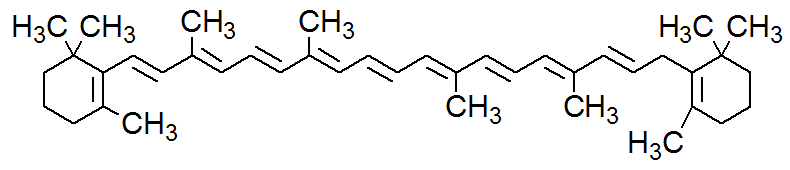
Fórmula estrutural do Betacaroteno
Ao ser oxidado, sob influência do KMnO4, o betacaroteno é transformado em vitamina A (retinol).
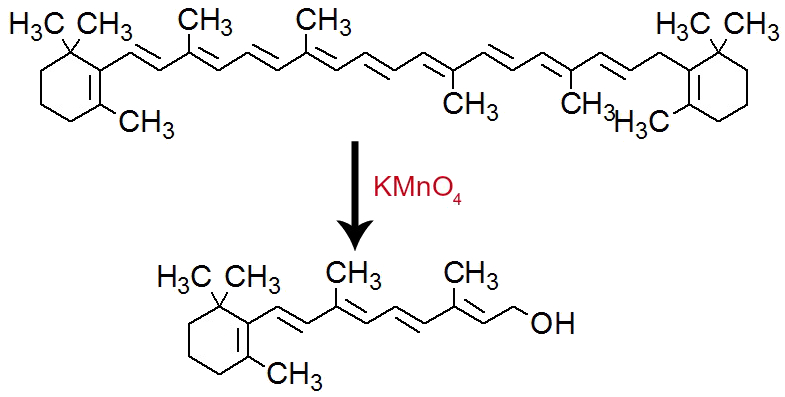
Equação de formação da vitamina A por meio da oxidação do betacaroteno
O experimento terá uma coloração marrom avermelhada ao final.
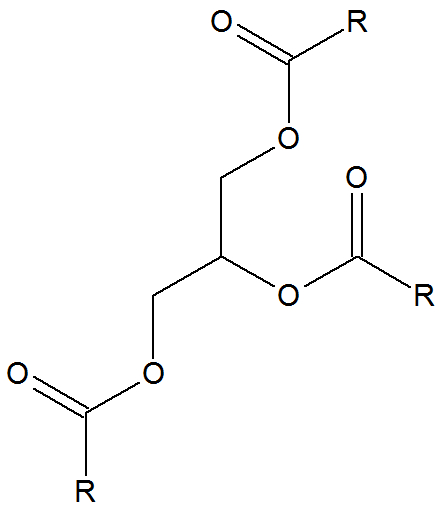
Fórmula estrutural do ácido graxo
O ácido graxo apresenta radicais laterais (R) que possuem duplas ligações. Durante a oxidação, essas ligações duplas são rompidas, ocorrendo a formação de glicerol.
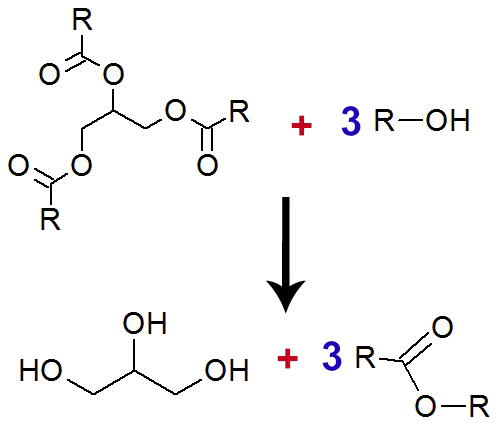
Equação de formação do glicerol a partir do ácido graxo
O experimento terá uma coloração marrom avermelhada ao final.
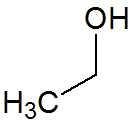
Fórmula estrutural do Etanol
Durante a oxidação, um ou mais hidrogênios localizados no carbono que possui o grupo OH são oxigenados. Com isso, temos a formação de um álcool gemino (aquele que possui duas ou mais hidroxilas no mesmo átomo de carbono), uma substância muito instável.
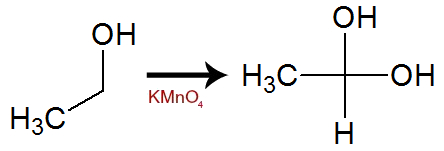
Equação de formação de álcool gemino com dois OH a partir do etanol
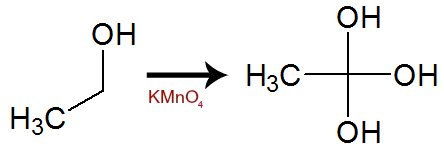
Equação de formação de álcool gemino com três OH a partir do etanol
As hidroxilas do álcool gemino dão origem a uma molécula de água. Se apenas um hidrogênio do carbono citado for oxigenado, a oxidação formará aldeído. Já se os dois hidrogênios do carbono forem oxidados, a oxidação formará um ácido carboxílico.
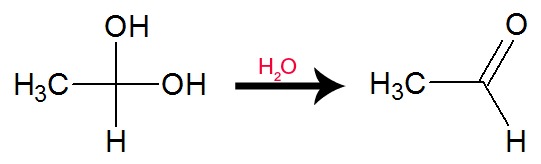
Equação de formação de aldeído
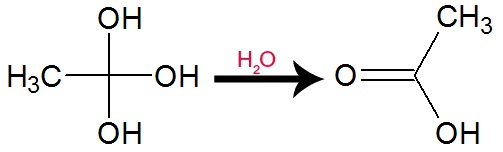
Equação de formação de ácido carboxílico
O experimento terá uma coloração marrom avermelhada ao final.
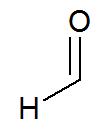
Fórmula estrutural do formaldeído
Durante a oxidação, o hidrogênio localizado na carbonila (possui carbono ligado a um hidrogênio e a um oxigênio) recebe um átomo de oxigênio, transformando a carbonila em carboxila (possui carbono ligado a um OH e a um oxigênio).
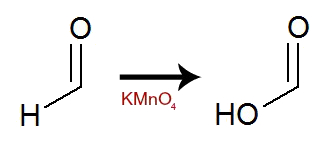
Equação representando a formação da carboxila a partir da carbonila
O experimento terá uma coloração marrom avermelhada ao final.
Por Me. Diogo Lopes Dias

















