Introdução:
Existem várias formas de calcular a energia de combustão ou entalpia de combustão de forma teórica. Esses cálculos mostram que a entalpia da combustão completa é maior que a da combustão incompleta. Para que o professor possa comprovar isso para os alunos, propomos uma sugestão de aula experimental sobre o tema.
O experimento sobre entalpia de combustão completa e incompleta que abordaremos aqui também pode ser utilizado para evidenciar alguns aspectos do cotidiano, tais como:
- Por que um motor de um carro desregulado gasta mais gasolina?
- Por que as chamas vistas nas combustões ora são amarelas, ora são azuis?
Antes, porém, vamos apenas relembrar alguns aspectos teóricos que devem ser abordados antecipadamente com os alunos.
Conforme explicado no texto Combustão completa e incompleta, a combustão ocorre quando algum material oxidável (combustível) reage com o oxigênio (comburente), que sofre redução. Se houver oxigênio suficiente para consumir todo o combustível, haverá uma combustão completa, que produzirá dióxido de carbono e água:
Combustão completa: COMBUSTÍVEL + O2 → CO2 + H2O
Exemplo: Combustão completa do gás metano:
CH4 + 2 O2 → CO2 + 2 H2O ∆H0combustão= -758,0 kJ/mol
Por outro lado, se não houver oxigênio suficiente para a oxidação completa do combustível, a reação que ocorrerá será uma combustão incompleta. Dependendo da concentração de oxigênio disponível, podem ser formados como produtos monóxido de carbono (CO) e água, ou fuligem (C) e água.
Combustão incompleta: COMBUSTÍVEL + O2 → CO + H2O ou
COMBUSTÍVEL + O2 → C + H2O
Exemplo: Combustões incompletas do metano:
CH4 + 3/2 O2 → CO + 2 H2O ∆H0combustão= -520,0 kJ/mol
CH4 + O2 → C + 2 H2O ∆H0combustão= -408,5 kJ/mol
Em todo tipo de combustão, há liberação de calor, ou seja, é uma reação exotérmica. No entanto, a quantidade de energia liberada nas combustões completas é maior que a liberada nas combustões incompletas. Isso é visto por meio do valor da variação de entalpia-padrão (∆H0) nas equações termoquímicas acima. O sinal negativo presente em todos os casos serve apenas para indicar que a reação liberou calor, e não absorveu.
Com esses aspectos em mente, vamos agora ao experimento sobre entalpia de combustão completa e incompleta. Para realizá-lo, o professor precisará de:
Materiais e Reagentes:
* Água;
* Bico de Bunsen;
* 2 béqueres ou erlenmeyers;
* Termômetro;
* Tripé;
* Tela de aquecimento.
Procedimento experimental:
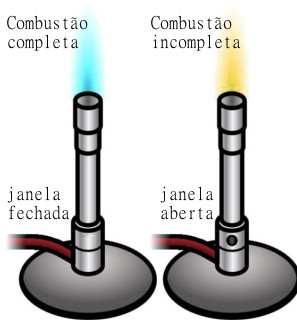
Coloque a mesma quantidade de água em dois béqueres e meça e anote a temperatura inicial. Leve-a para aquecer na tela de aquecimento que ficará sobre o tripé e acenda o bico de Bunsen. No caso do primeiro béquer, deixe a janela do bico de Bunsen aberta e, no segundo caso, deixe a janela fechada. Cronometre para ver qual água atingirá a temperatura de 50ºC primeiro.

Resultados e discussão:
Por meio desse experimento, os alunos notarão que a água do béquer que foi aquecido pelo bico de Bunsen com as janelas fechadas demorou mais para atingir a temperatura de 50º. Isso acontece porque, quando a janela está fechada, há entrada de uma pequena quantidade de ar, ou seja, não há oxigênio suficiente, e a reação é incompleta. Essa combustão incompleta é a menos energética, porque demorou mais para aquecer a água, e, consequentemente, é a que possui menor ∆H.
Por outro lado, quando a janela do bico de Bunsen está aberta, há uma regulagem adequada da mistura gás-ar, logo, há oxigênio suficiente para a combustão completa, que é mais energética.
Os alunos poderão perceber também que, quando a janela está fechada, a chama possui cor amarela, sendo também denominada de chama fria. Essa cor é característica da combustão incompleta, pois nesse tipo de reação há a presença de carbono (incandescente). Já a chama da combustão completa é azul e é chamada de chama quente.
Além disso, essa aula serve para mostrar que, se um motor está desregulado, ocorrem grandes quantidades de combustões incompletas, o que resulta em um gasto maior de combustível para obter a mesma quantidade de energia que um motor regulado ou para obter a mesma quantidade de energia necessária para o seu funcionamento mais adequado.
Por Jennifer Fogaça
Graduada em Química

