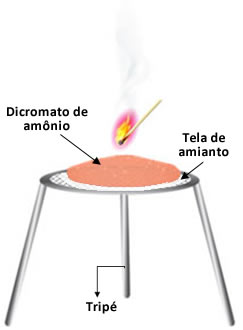
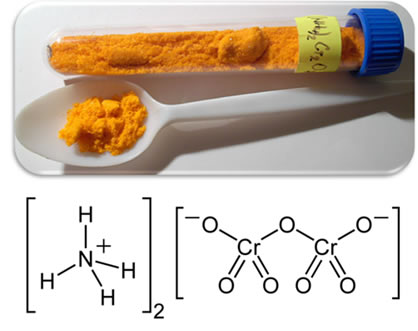
Artigos relacionados
Estratégias de ensino-aprendizagem
Decomposição da água oxigenada
Como a enzima catalase influi sobre reações químicas.
Estratégias de ensino-aprendizagem
Evidências da ocorrência de reações químicas
Professor, quer ajudar seus alunos a saberem a diferença entre fenômenos físicos e químicos e conseguir indicar se houve uma reação química ou...
Estratégias de ensino-aprendizagem
Exemplo de reação de decomposição
Experimento fácil que pode ser usado em sala de aula para explicar como ocorre uma reação de decomposição e como atuam os catalisadores.
Estratégias de ensino-aprendizagem
Experimento sobre balanceamento e tipos de reações químicas
Explicação de três experimentos simples que podem ser feitos em laboratório ou em sala de aula, sobre o conteúdo de tipos de reações.
Estratégias de ensino-aprendizagem
Fenômenos físicos e químicos
Aula experimental sobre a transformação da matéria.
Estratégias de ensino-aprendizagem
Reações entre íons em soluções
Veja como você pode prever se ocorrerá alguma reação com formação de precipitado quando se misturam soluções de íons.
Estratégias de ensino-aprendizagem
Teste da velocidade das reações
Descubra quais os fatores que influem em uma reação através de um simples procedimento.