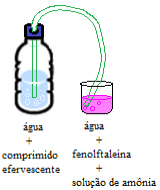
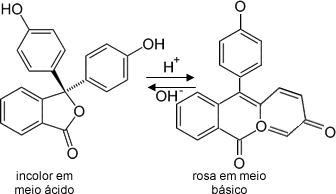
Artigos relacionados
Estratégias de ensino-aprendizagem
Deslocamento do equilíbrio químico e mudança de cor
Confira um experimento que explica como funcionam os “galinhos do tempo”, bibelôs que mudam de cor e ajudam a prever o tempo por meio do...
Estratégias de ensino-aprendizagem
Efeito do íon comum no equilíbrio
Realize essa atividade experimental simples em sala de aula, utilizando produtos caseiros, sendo possível observar como ocorre o efeito do íon...
Estratégias de ensino-aprendizagem
Equilíbrio químico
Aula experimental que permite visualizar o equilíbrio de um sal.
Estratégias de ensino-aprendizagem
Faça seu próprio indicador ácido-base
Determinando a acidez de soluções a partir do repolho.
Estratégias de ensino-aprendizagem
Indicador derivado da beterraba
Faça seu próprio indicador!
Estratégias de ensino-aprendizagem
Indicador ácido-base natural
Aprenda a produzir um indicador a partir da flor de Hibisco.
Estratégias de ensino-aprendizagem
Indicadores naturais
Indicador ácido base a partir de frutas.
Estratégias de ensino-aprendizagem
Obtenção de um equilíbrio químico
Veja um experimento para trabalhar os conteúdos de Equilíbrio Químico, Princípio de Le Chatelier e deslocamento do equilíbrio pela temperatura.
Estratégias de ensino-aprendizagem
Papel indicador
Aprenda a fazer seu próprio indicador ácido-base.
Assista às nossas videoaulas